מהו ניוון מקולרי גילי (AMD)?
ספקטרום המחלה (שלבי ניוון מקולרי גילי)
אפידמיולוגיה - תפוצת המחלה באוכלוסיה
הדרכים המובילות לאיבוד הראייה
פגיעת ניוון מקולרי גילי באיכות החיים
הטיפול בניוון מקולרי גילי
שיקום ראייה לחולי ניוון מקולרי גילי
מהו ניוון מקולרי גילי
ניוון מקולרי גילי (נמ"ג) הוא הגורם הראשון במעלה לעיוורון בגיל המבוגר. נסקור את הספקטרום הקליני, את גורמי הסיכון, את הפתופיסיולוגיה ואת האפשרויות לטיפול בנמ"ג. למרות שכיום יש מספר אפשרויות לטיפול במחלת הנמ"ג, עדיין אין טיפול המרפא אותה כליל. בעלת חשיבות מכרעת היא שימת הלב לגורמי הסיכון הניתנים לשינוי כגון איזון לחץ הדם, הפסקת עישון, ומעקב שיגרתי אחר מצב העיניים על מנת לאפשר התערבות מוקדמת. בנוסף לכך, הערכת מצב הראייה לצורך התאמת עזרי ראייה שונים עשויה להביא תועלת רבה לחלק מהחולים הסובלים מירידה בכושר הראייה. לבסוף, חינוך בנושא ההתפתחות הקלינית של ניוון מקולרי גילי, כמו גם מידע לגבי התועלת הידועה שבטיפולים הזמינים עשויים להעניק לחולים הבנה טובה יותר של מצבם.
אחת הדאגות עיקריות של אנשים מתבגרים היא הראייה. ניוון מקולרי גילי נשאר הסיבה העיקרית לעיוורון באנשים בגיל מתקדם. 1 נמ"ג פוגע במקולה, האזור האחורי של הרשתית, האחראי לראייה המרכזית. מעריכים כי כ- 13-14 מיליון אנשים בארה"ב סובלים מצורה כלשהי של נמ"ג 1-3, ועד שנת 2020 מספר זה צפוי לגדול ב- 50%. לאחרונה חלה התקדמות משמעותית בהבנתנו את הנמ"ג. המנגנון המדויק האחראי להתקדמות המחלה נשאר עדיין לא ברור, אולם החלופות העומדות לרשותנו לצורך הטיפול במחלה זאת ממשיכות להתרחב.
ספקטרום המחלה (שלבי ניוון מקולרי גילי)
ניוון מקולרי גילי ראשוני
ניתן לסווג את הנמ"ג לשלוש קבוצות: ראשוני, ביניים ומתקדם. כ-90% מהמקרים שייכים לקבוצה הראשונית ולקבוצת הביניים. בניגוד לכך, הקבוצה המתקדמת מהווה כ- 88% ממקרי העיוורון שניתן לייחסם לנמ"ג. 4 הסימנים המוקדמים של נמ"ג הם משקעים צהובים זעירים בשכבות העמוקות של המקולה, הידועים בשם "דרוזן" (תמונה 1). בנוסף לכך, ניתן להבחין באזורים בהם יש שינויים בפיגמנטציה בשכבת הפיגמנט הרשתי של המקולה. איבוד הראייה הקשור בשינויים אלה עשוי להיגרם באופן הדרגתי על ידי אטרופיה של שכבת הפיגמנט של הרשתית ושל הקולטנים הנמצאים לידה. הצורה הראשונית של הנמ"ג עלולה להתקדם לצורת הביניים ולצורה המתקדמת.
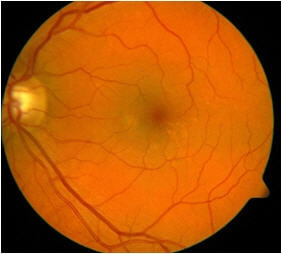
תמונה 1 נמ"ג מוקדם: דרוזן קטנים ומשקעים של פיגמנטים במקולה
ניוון מקולרי גילי ביניים
ניתן להתייחס לנמ"ג ביניים כאל צורת נמ"ג ראשוני בעלת סיכון ומאפיינים קליניים נרחבים יותר (תמונה 2). דו"ח מוקדם של מחקר מחלות העיניים הקשורות בגיל הראה כי עיניים בעלות סוג מסוים ורמה מסוימת של דרוזן נמצאים בסיכון גבוה לפתח נמ"ג מתקדם עם איבוד ראייה. 5 צורה זאת של נמ"ג מכונה נמ"ג ביניים. קבוצת מחקר הציגה לאחרונה סולם חומרה של נמ"ג. השלבים של היתכנות גוברת להתקדמות נמ"ג לא מתקדם לנמ"ג מתקדם הורכבו מגורמי סיכון נבחרים. בגרסה פשוטה שהוצגה בדוח זה, גורמי הסיכון מיוחסים באופן מצטבר עבור התכונות הכוללות: אי-תקינות פיגמנט, דרוזן גדולים, דרוזן דו צדדי בגודל בינוני, ונמ"ג חד צדדי נאו-וסקולרי.ניתן לייחס 0, 1, 2, 3, 4 גורמי סיכון לקצב התקדמות לנמ"ג מתקדם תוך 5 שנים של 0.5%, 3%, 12%, 25% ו- 50% בהתאמה.6-8
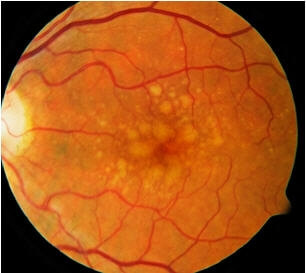
תמונה 2 נמ"ג ביניים: דרוזן בעלי ממדים בינוניים וגדולים מצטברים תחת הרשתית
ניוון מקולרי גילי מתקדם
למרות שנמ"ג מתקדם פחות שכיח מהצורה הראשונית ומצורת הביניים, איבוד הראייה הפוטנציאלי בגלל נמ"ג מתקדם משמעותי יותר. לנמ"ג מתקדם שתי תת קבוצות קליניות. נמ"ג רטוב (או נאו-וסקולרי) הוא הסוג השכיח והוא מאופיין על ידי התפתחות כלי דם לא תקינים בדמית (אזור עשיר מאוד בכלי דם הנמצא בין לובן העין לבין האפיתל הצבעוני של הרשתית). כלי דם אלה נקראים ממברנות והם עלולים להתפתח לתוך החלל התת רשתי וברשתית תוך דליפה של נוזל ודם, ולגרום נזק ואיבוד ראייה (תמונה 3). מאפיינים אחרים של נמ"ג רטוב הם היפרדות האפיתל הצבעוני של הרשתית ופיברוזיס, המכונה לעיתים צלקת בצורת דסקית, הנוצרת בשלבים המאוחרים של המחלה. 9
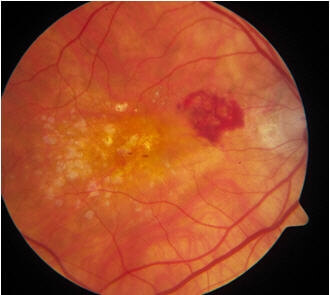
תמונה 3 נמ"ג מתקדם : המראה הרמת רשתית בצבע אפור ירקרק עם דימום ונוזל תת רשתי בנוסף לדרוזן גדולים ובינוניים
תת הסוג השני של נמ"ג מתקדם כולל אטרופיה המתקדמת לאזורי רשתית משמעותיים מבחינת הראייה, כגון הפובאה האחראית לחדות הראייה המרכזית. אטרופיה מתקדמת בשטח נרחב מכונה אטרופיה גיאוגרפית (תמונה 4) ועלולה לגרום לאיבוד ראייה חמור. חולים הסובלים מנמ"ג מתקדם רטוב יבחינו לעתים קרובות בשינוי פתאומי בראייה או בעיוות ראייה חדש. ברוב הגדול של החולים הסובלים מנמ"ג מתקדם, רטוב או יבש, הרשתית ההיקפית נשארת ללא פגיעה, ולכן הראייה ההיקפית והאמבולטורית נשארת טובה. חשוב להרגיע את חולי נמ"ג ש"עיוורון מוחלט" הוא נדיר ביותר.
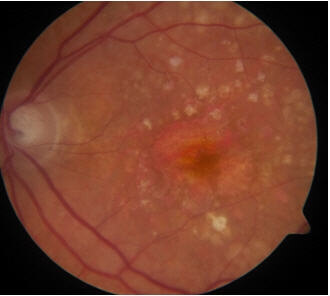
תמונה 4 נמ"ג מתקדם: אטרופיה גיאוגרפית נוצרת על ידי איבוד אפיתל צבע ברשתית וחשיפה של כלי הדם בדמית שמתחתיה
אפידמיולוגיה - תפוצת המחלה באוכלוסיה
מחקר העין דיווח כי 30% מהאנשים שגילם מעל 75 סובלים מצורה כלשהי של נמ"ג, מתוכם 7% סובלים מנמ"ג מתקדם. 5 מחקרים עכשוויים מעריכים כי 8 מיליון אנשים בארה"ב נחשבים בסיכון לפתח נמ"ג מתקדם תוך חמש השנים הבאות, כאשר 1.75 מיליון כבר סובלים מנמ"ג מתקדם. 2,3
הסיבה להתפתחות נמ"ג איננה ידועה עדיין. גורמי סיכון מוסכמים הם: גיל, גזע לבן ותורשה 10,11 קיים קשר חלש בין יתר לחץ דם לבין נמ"ג, וקשר חלש עד בינוני בין נמ"ג והביטויים הקליניים של מחלות לב וכלי דם. 12,13 העישון הוכח כגורם הסיכון הניתן לשינוי בצורה העקבית ביותר. 14מחברים אחדים דיווחו על רמות מוגברות של גורם הגידול של כלי הדם (VEGF) בפלסמה, גורם פון ווילברנד, ופיברינוגן, כמו גם על צמיגות יתרה של הפלסמה אנשים הסובלים מנמ"ג. 15 ממצאים אלה מדגישים את חשובות סמני אנגיוגנסיס, המוסטזיס ופעילות אנדותלית לא תקינה בנמ"ג, ונתמכים על ידי מחקר רוטרדם שדיווח על קשר בין נמ"ג והסתיידות עורקים. 16 מחקרים בתאומים וניתוחים גנטיים אחרים מצביעים על התפקיד אותו ממלאים הגורמים התורשתיים בנמ"ג. 11,17-19 עם זאת, השפעת הגורמים התורשתיים והסביבתיים על התקדמות המחלה אינם ידועים.
הדרכים המובילות לאיבוד הראייה
לא קיימים בטבע מודלים של נמ"ג בבעלי חיים. עבודות בעכברים טרנסגניים סיפקו רמזים אחדים לגבי הפתוגנזה של נמ"ג. רודולף ושות. הראו שתזונה עשירה בשומנים בעכברים חסרי קולטן LDL גרמו להתנוונות השכבות העמוקות של הרשתית ולהצטברות של חלקיקי שומנים הדומים לנמ"ג יבש או לא מתקדם.20 אמבטי ושות. דיווחו כי עכבר חסר חלבון-1 מונוציט כמואטרקטנט (1-MCP), או הקולטן שלו יפתח דרוזן עם אטרופיה של קולטנים ו- CNV בדומה ל נמ"ג בעל משקעים.21 מחקרם מציע כי ייתכן כי גם לפעילות דלקתית חריגה תפקיד בפתוגנזה של נמ"ג.
ייתכן כי ל- VEGF תפקיד מפתח בפתוגנזה במודלים של CNV בעכברים וקופים, ניתן היה ליצור קורלאציה בין ביטוי ה VEGF והתפתחותCNV . 26 נתונים אלה מרמזים על כך ש- VEGF הוא גורם המעודד הופעת CNV. אחרים בדקו מתן גורמי גידול כולל VEGF בצורה תת-רשתית.27 עם זאת, ייתכן כי אין די במולקולה זאת לבדה על מנת לגרום להופעת כלי דם חדשים; כנראה שמעורבים גם גורמי גידול אחרים, נזק באנדותל של נימי הדמית, וציטוקינים דלקתיים. לאחרונה הראה מחקר גנטי שמוטציות בגן הקשור לגורם המשלים H על כרומוזום 1 קשורות באופן הדוק לנמ"ג.28-30 הדבר תומך באטיולוגיה דלקתית לגבי נמ"ג.
פגיעת ניוון מקולרי גילי באיכות החיים
איבוד הראייה המרכזית הנגרם על ידי נמ"ג עלול להשפיע באופן משמעותי על איכות החיים של החולה על ידי פגיעה חמורה במטלות היומיות הבסיסיות כגון קריאה, נהיגה וזיהוי פני אנשים. בנוסף לכך, כשליש מהחולים הסובלים מנמ"ג סובלים גם מדיכאון. 31-32 חומרת המחלה קשורה בתפקוד ראייתי לקוי, איכות חיים ירודה ורמה גבוהה יותר של דיכאון בהשוואה לאוכלוסייה רגילה.32,33 איבוד הראייה עלול להשפיע בצורה חמורה על יכולתו של אדם לבצע פעילויות יומיות, (כגון צפייה בטלוויזיה, קריאת תוויות על מוצרי מזון וזיהוי פני אנשים), כמו גם על הניידות ועל ההתמצאות במרחב.34-39 איבוד היכולת לזהות את פניהם של בני משפחה וחברים במיוחד עלול לגרום מצוקה גדולה. איבוד הראייה מגדיל את הסיכון הנפילה ואת הצורך במטפל צמוד 40.
הטיפול בניוון מקולרי גילי
זיהוי סימני הנמ"ג המתקדם חיוני להצלחת הטיפול למניעת איבוד הראייה. בדיקה עצמית של הראייה המרכזית באמצעות רשת אמסלר (תרשים 5) עשוי לסייע בגילוי שינויים קלים בראייה או עיוות, כמו גם לעקוב אחר שינויים בראייה לאחר גילויים. אחד מסימני ההיכר של התקדמות הנמ"ג הוא קושי בראייה בתנאי תאורה חלשה. מומלץ שחולים המבחינים בשינוי בראייה יעברו בדיקות אצל מומחה לרשתית.
אסטרטגיות לטיפול בנמ"ג מתפתחות בקצב מהיר. לפני 1999, הטיפול היחיד הזמין עבור הצורה המתקדמת של נמ"ג הקשורה בהופעת כלי דם חדשים היה טיפול לייזר תרמי. עם הכנסת הטיפול הפוטו-דינמי באמצעות וידוזיין ולאחר מכן גורמים נוגדי VEGF (מקוגן, אווסטין ולוסנטיס), האפשרויות לטיפול באמצאות תרופות ממשיכות להתפתח. הודות לשינויים המהירים בניהול המחלה, מוצע להחולים מבחר גדול של אופציות טיפוליות כולל צירופים של גורמים קיימים. מספר רב של ניסויים קליניים מתנהל כיום על תרופות אלה. מאחר שידוע כי הפסקת העישון והשיפור בגורמי הסיכון למחלות לב וכלי הדם הם משתנים חשובים בהתקדמות הנמ"ג 14 , חשוב שהחולים הסובלים מכל אחת מצורות הנמ"ג ימנעו מעישון ויקבלו יעוץ מתאים לאיזון גורמי הסיכון.
נמ"ג מוקדם
לא קיימות אסטרטגיות מוכחות למניעת נמ"ג, ואין טיפול לשלבים ההתחלתיים של המחלה. יש להסביר לחולים עם נמ"ג מוקדם שלמרות שיש סיכוי טוב כי ישמרו על ראייה טובה, נמ"ג מוקדם עלול להתקדם, ולכן מומלץ לבצע בדיקה עצמית ובדיקות מתוכננות אצל רופא העיניים.
נמ"ג ביניים
מחקר מחלות העיניים הקשורות בגיל (AREDS ) קבע שנטילת מנות גבוהות של ויטמינים נוגדי חמצון ותוספות אבץ מקטין בצורה מתונה את הסיכון להידרדרות חמורה בראייה אצל חולים עם נמ"ג בסיכון גבוה. 5 הטיפול הועיל במיוחד לחולים עם צורת ביניים של המחלה - מחלה מוקדמת עם התקדמות שינויים קליניים. למרות שקיימים תכשירים רבים אחרים שיתכנו כמועילים לגבי נמ"ג, כגון לוטאין, חסרים ממצאים העשויים לבסס המלצה לנטילתם על ידי החולים. כיום מתנהלים ניסויים קליניים להערכת גורמים אלה כמו גם התערבות תרופתית אנטי-אנגיוגנית מונעת עבור חולים בנמ"ג ביניים.
נמ"ג מתקדם
לא קיים כיום טיפול מוכח או טיפול מונע עבור הסוג האטרופי המשני הידוע בשם אטרופיה גיאוגרפית. הסוג הרטוב של נמ"ג מתקדם מטופל כיום באמצעות מספר אסטרטגיות.
לייזר תרמי משמש לטיפול בצורות מסוימות של נמ"ג רטוב. עם זאת, בעודו מטפל בגידול כלי דם חדשים, הלייזר התרמי הורס את השכבה העליונה של הרשתית. מכאן שהשימוש בו מוגבל, כאשר מדובר בפגיעה בתוך האזור המקולרי המרכזי. לפני הופעת הטיפולים החדשים, הדרכים העיקריות לניהול כל צורות הנמ"ג הרטוב המתקדם היו לייזר ומעקב. 41, 42 הכנסת הטיפולים החדשים צמצמה את השימוש בלייזר תרמי למקרים בהם יצירת כלי דם חדשים אינה פוגעת במקולה המרכזית.
הטיפול הפוט-ודינמי ב-veterporphin (PDT ) משלב אינפוזיה תוך ורידית של הצבע הרגיש לאור, וטרפורפין, עם לייזר בעל עוצמה נמוכה המכוון אל רקמת כלי הדם החדשים. הלייזר מפעיל את הצבא הפוטו-דינמי המשחרר רדיקלים חופשיים שאוטמים את הנימים הלא תקינים בדמית. טיפול זה הוכח כמועיל במקרה של סוגים מסוימים של פגיעות CNV בנמ"ג מתקדם.43-45 יעילותו עולה על זו של טיפולי לייזר רגילים בפגיעות במקולה המרכזית, הודות ליכולתו להתמקד באופן סלקטיבי ברקמת כלי דם פתולוגית ללא פגיעה (באופן יחסי) ברקמה התקינה שמעליה. VEGF גורם המאיץ יצירת כלי דם חדשים וגורם חדירות, הוא מטרה אטרקטיבית לטיפולים חדישים. VEGF הוא חלבון הנוצר כתוצאה משחבור חליפי של RNA שליח היוצר לפחות 6 גרסאות, מהן הגרסה 165-VEGF היא הצורה הפתוגנית העיקרית. 46 מקוגן (pegaptanid sodium) המתביית על גרסת החלבון 165-VEGF הוא הגורם האנטי-אנגיוגני הראשון לטיפול תוך עיני שהוכח כמסייע בטיפול בנמ"ג רטוב. הוא מוזרק בתוך הזגוגית (ישירות לעין) כל 6 שבועות למשך שנה אחת לפחות, כפי שהראה המחקר הרב מרכזי האקראי המוסווה שקבע את יעילותו בהשוואה לטיפולים קיימים בנמ"ג רטוב. 47 המחקר לדיכוי VEGF ביצירה תוך עינית של כלי דם חדשים הוכיח שחולים שטופלו ב- pegaptanid sodium אבדו פחות אותיות של חדות ראייה מאשר מטופלים בקבוצת בקורת שקיבלו טיפול רגיל. תופעות לוואי חמורות הקשורות בהזרקה כולל דלקת תוך עינית, הפרדת רשתית וקטרקט שנצפו בפחות מ- 1.3 אחוזים מהמטופלים. לא היו תופעות לוואי מערכתיות שניתן ליחס ל- pegaptanid sodium. בניגוד ל - pegaptanid sodium , לוסנטיס (ranibizumab) הוא מקטע של נוגדן חד שבטי אנושי ספציפי לכל הגרסאות של VEGF אנושי 48. Ranibizumab מנטרל את האינטראקציה עם קולטני VEGF. שלא כמו הנוגדן הגדול השלם (אווסטין), בניסויים בקופים מסיג רסוס, ranibizumab הצליח לחדור את הממברנה הפנימית ולהגיע לחלל התת רשתי לאחר הזרקה בתוך הזגוגית 49,50. לוסנטיס היא הטיפול הראשון לנמ"ג שהוכיח שיפור בחדות הראייה בניסויים קליניים כנגד האטת איבוד הראייה 51.
ה- FDA אישר ranibizumab (לוסנטיס) ביוני 2006 במינון של 0.5 מ"ג להזרקה תוך עינית. עם זאת, בינואר 2007, היצרן של ranibizumab פרסם מכתב לרופאים בו הוא מזהיר מפני הסיכון המוגבר לשבץ במינון המאושר על ידי ה-FDA , 0.5 מ"ג, בהשוואה למינון נמוך יותר של 0.3 מ"ג שנחקר. בדיקת ביניים של מחקר SAILOR (בדיקת בטיחות לוסנטיס תוך זגוגי עבור נמ"ג) שהשוואה שני מינונים להזרקת ranibizumab בתוך הזגוגית לטיפול ב- AMD הקשור ביצירת כלי דם חדשים הראה סיכון של 1.2% לשבץ במטופלים ב-0.5 מ"ג לעומת 0.3% במטופלים ב 0.3 מ"ג (p=0.02 ). נתוני SAILOR מרמזים על כך שהסיכון לשבץ איסכמי גבוה יותר אצל חולים עם היסטוריה של שבץ.
לא היה הבדל סטטיסטי משמעותי ביחס לאוטם שריר הלב או מוות כתוצאה מבעיה בכלי הדם בין שני המינונים.
שני מחקרים אחרים, MARINA (ניסוי מינימלי קלסי / סמוי בנוגדן ה VEGF ranibizumab בטיפול בנמ"ג הנגרם על ידי צמחית כלי דם חדשים) ו- ANCHOR (נוגדן VEGF לטיפול ביצירת קלאסית של כלי דם חדשים בדמית בנמ"ג), ציין גם כן גידול קטן בסיכון לשבץ במינון של 0.5 מ"ג, שלא הגיע לרמות משמעותיות מבחינה סטטיסטית. 52, 53 הזרקה שלא על פי התוויה של אווסטין- bevacizumab בתוך הזגוגית שימשה לטיפול במחלות הקשורות ביצירת כלי דם חדשים ומשקעים תוך עיניים, כולל נמ"ג, עם מספר ניסויים קטנים, לפני אישור ranibizumab והוצאתו לשוק. במהלך השנים האחרונות פורסמו מספר מקרים המתעדים את השימוש בו. 55-53 Bevacizumab הוא נוגדן חד שבטי של VEGF הקשור מבחינת המבנה ל- ranibizumab בכך ששניהם פותחו באופן מקורי מאותו נוגדן עכבר. Ranibizumab קטן יותר ומהונדס גנטית בתהליך של מוטציה סלקטיבית על מנת להגדיל את זיקתו להתחברות ולדיכוי כל הצורות הביולוגיות הפעילות של VEGF-A . Bevacizumab, מצד שני, הוא בעל שני מקטעים Fab כמו גם מקטע Fc.
טיפולים נוספים בניוון מקולרי גילי
אופציות הטיפול הנותרות בהן נדון בהמשך משמשות בדרך כלל לטיפול בנמ"ג רטוב מתקדם, למרות שלא התנהלו ניסויים קליניים לקביעת יעילותם. בניגוד לכך, קיימות ראיות לגבי יעילות הטיפולים המבוססים על לייזר, PDT pegaptanid sodium ו- Ranibizumab בטיפול בנמ"ג רטוב בהשוואה למעקב או טיפולים אחרים.
הסטרואידים היו חלק מהטיפולים התרופתיים הראשונים שנבדקו לצורך הטיפול ב- CNV. לסטרואידים תכונות נוגדות יצירת כלי דם חדשים, הצטלקות וחדירות. למרות שההשפעה הקלינית של הסטרואידים עשויה לכלול הפחתה בדליפה מכלי הדם, מנגנון השפעה זאת עדיין לא מובן דיו. השימוש מחוץ לעין ב- triamcinolone acetate שכיח בטיפול במחלות עיניים דלקתיות. ישנם מספר ניסויים בקנה מידה קטן בחולים בנמ"ג רטוב המראים תועלת מסוימת בהזרקה תוך עינית של triamcinolone acetate. העובדה כי שימוש תוך עיני בסטרואידים עלול להשפיע על ה CNV עומדת בקנה אחד עם נוכחות גורם דלקתי בפתוגניות של נמ"ג.57 למרות שלא נבדק מעולם בניסוי קליני, triamcinolone acetate המוזרק בתוך הזגוגית נמצא בשימוש יחד עם PDT אצל מומחי רשתית המרגישים שלצירוף זה עשוי להיות אפקט קליני סינרגי בהשוואה לכל אחד מהטיפולים כאשר הם ניתנים בנפרד.58-60 עם זאת, הסטרואידים מהווים סיכון ליצירת לגלאוקומה וקטרקט.כמוכן קיים חשש כי הסטרואידים עלולים להיות רעילים עבור הרשתית, ועלולים לגרום לאיבוד ראייה בעתיד. 60, 61 ניסויים קליניים הבודקים את התרומה בשימוש בסטרואידים בצורה זאת נמצאים בעיצומם.
ניסוי בניתוח תת-מקולרי דיווח שהסרה כירורגית של מכלול כלי הדם החדשים אינו מביא לכל שיפור בראייה אצל החולה הסובל בנמ"ג רטוב. 62תוארה גם הסרה כירורגית של דימום חדש תת רשתי יחד עם טיפול אורוקינז תת רשתי לצורך המסת הדם. לאחר סילוק הדימום, ניתן לבצע אנגיוגרפיה על מנת לשקול את הטיפולים הלא כירורגיים המתוארים מעלה. 63 אין עדיין הסכמה מלאה לדבר, ומספר החולים בדוחות הקליניים קטן יחסית.

תמונה 5 רשת אמסלר: רשת אמסלר מורכבת מקווים אנכיים ואופקיים במרחקים שווים המודפסים על נייר לבן או שחור. נקודה קטנה ממוקמת במרכז הרשת לצורך מיקוד. בזמן ההסתכלות בנקודה, החולה מחפש קווים גליים ושטחים חסרים ברשת.
שיקום ראייה לחולי ניוון מקולרי גילי
60% מתוך החולים הסובלים מאיבוד ראייה עקב נמ"ג מדווחים על ירידה משמעותית ביכולתם להשתתף בפעילויות חשובות כגון קריאה, נהיגה, וצפייה בטלוויזיה 64. התייעצות עם מומחה לליקויי ראייה חשובה לצורך זיהוי שינויים שניתן לבצע בפעילות היום-יומית עבור כל חולה באופן אישי. גם חולה עם איבוד מזערי של חדות ראייה יכול/ יכולה ליהנות ממשקפי ראייה או מכשירי הגדלה שיעזרו לו / לה בפעולות היום-יומיות כמו קריאה או תנועה בתוך הבית. חשוב להתייחס לשיקום ראייה כאל סוג טיפול עבור חולי נמ"ג. מאחר שנמ"ג קשור בירידה משמעותית באיכות החיים ודיכאון קליני בשליש מהחולים 31, הטיפול בדיכאון עשוי גם הוא להוות חלק חשוב בשיקום.
לסיכום
נמ"ג היא מחלה אשר עשויה לגרום נכות ראייה. הזמן הקריטי להתערבות הוא בשלבים המוקדמים של המחלה, כאשר חדות הראייה נפגמה רק במעט. טיפולים עבור הצורה המתקדמת של נמ"ג עשויים להועיל במידה ניכרת. הסבר מפורט לחולה ושיקום הראייה הם גורמים חשובים לא פחות בטיפול בנמ"ג.
קראו עוד על ניוון מקולרי גילי - AMD:
זיהוי מוקדם של המחלה
הגנטיקה של ניוון מקולרי גילי - AMD
ניתוח לטיפול בניוון מקולרי גילי - AMD