רקע
מחלת התריס העינית (Thyroid Eye Disease - TED), היא מחלה אוטואימונית נדירה, המופיעה בדרגות חומרה שונות.
התסמינים השכיחים כוללים רטרקצית עפעפיים (פתיחה ביתר), בלט עין (פרופטוזיס), דלקת ארובה, עפעפיים ולחמית, שמתבטאת בין השאר באודם, נפיחות וכאב, יובש עיני, גירוי ודמעת.
ראיה כפולה עלולה להופיע בשלב הדלקתי או ההצטלקותי. במקרים נדירים, עלול להתפתח לחץ על עצב הראיה, או מתיחה שלו עם הפרעות בתפקודי העצב (DON - Dysthyroid Optic Neuropathy).
במקרים של בלט קיצוני עם רטרקצית עפעפיים משמעותית, עלולה להתפתח חשיפה של הקרנית, עם זיהום משני (עד כדי פרפורציה ספונטנית) ויציאה של גלגל העין קדימה מהארובה (סובלוקסציה globe subluxation) – האחרונים מחייבים התערבות טיפולית דחופה.
המחלה מתפתחת תחילה בשלב דלקתי חריף פעיל, שאורך בממוצע 6-18 חודשים ובהמשך מתייצבת לשלב כרוני, אשר במהלכו עלולים להיוותר נזקים תפקודיים ואסתטיים משמעותיים, עקב שינויים מבניים בארובת העין ובעפעפיים.
מרבית המטופלים חווים את המחלה בצורה קלה / בינונית ואינם סובלים מתסמינים מסכני ראיה.
בשלב הפעיל של המחלה, ניתן לטפל בה באופן שמרני בלבד, באמצעות טיפולים סיסטמיים אנטי דלקתיים, שכן התערבות ניתוחית עלולה לגרום לשפעול והחמרה של המחלה הדלקתית.
יוצאי דופן הם מקרים של מחלה חמורה המאיימת על הראיה, למשל במקרים של פגיעה בעצב הראיה, אז ניתן לשקול ניתוחים דחופים, כגון דקומפרסיה של ארובת העין, גם בשלב הפעיל.
במרבית המקרים, בהם אין איום מידי על הראיה, אך קיימת דלקת פעילה בדרגה בינונית עד חמורה, ניתן לטפל סיסטמית.
הקו הראשון שהיה נהוג עד כה בישראל, בכל המקרים של דלקת בינונית-חמורה, הינו טיפול בעירויי קורטיקוסטרואידים, אחת לשבוע, למשך 12 שבועות, עד למנה כוללת של 4.5-8 ג' מתילפרדניזולון (פרוטוקול EUGOGO)1,2 עם או ללא CellCept® (Mycophenolate mofetil).
במטופלים שבהם הטיפול נכשל או אינו מספק, ניתן לשקול טיפולים אימונולוגים אחרים עם יעילות משתנה, כגון נוגדנים כנגד CD-20 וכנגד IL-6. 3,4
בשנים האחרונות נכנסו לתמונה טיפולים ביולוגיים חדישים ובמרכזם טפזה (Tepezza – Teprotumumab), נוגדן חד-שבטי הפועל על הקולטן ל IGF-1.
מחקר שלב 3 כפול סמיות הדגים ירידה בפרופטוזיס ב 83% מהמטופלים שקיבלו טפרוטומומאב לעומת 10% בלבד בקבוצת הפלצבו5.
גם במדדים משניים כגון ציון הפעילות הקלינית (CAS), תגובה כוללת וכפל ראייה, הושגו תוצאות טובות יותר משמעותית בקבוצת הטפרוטומומאב. 5
במחקרים קליניים נוספים, טפזה הראתה יעילות רבה, עם הפחתה לא רק בתסמינים הדלקתיים אלא אף בבלט העין והפזילה.6–8
תרופה זו הינה נוגדן ל- insulin-like growth factor I receptor והינה התרופה הראשונה והיחידה שהינה מאושרת FDA לטיפול ב-TED בארה"ב, מאז אושרה לראשונה לשימוש בשנת 2020.
מעבר לכך, מחקרים מראים יעילות של התרופה, גם עבור מטופלים אלו בשלב הלא פעיל של המחלה, בו לרוב אין התאמה לטיפול סטרואידלי.9–11.
יתר על כן, גם במקרים מורכבים של נוירופתיה אופטית דיסתירואידית (DON), שלא הגיבו לטיפולים קודמים, הודגמה תגובה חיובית 12.
בעקבות מחקר שנערך בשנת 2023, עודכן אישור ה-FDA, כך שיכלול גם מטופלים בשלב הכרוני של המחלה, ובכך הורחב משמעותית מעגל המטופלים הזכאים לתרופה. 13
להפחתה של בלט העין ומידת הפזילה באופן תרופתי יש יעילות במניעת צורך בניתוחים מורכבים כגון דקומפרסיה של ארובת העין.
הטיפול בטפרוטומומאב ניתן באופן מסורתי לפי פרוטוקול קבוע: אינפוזיה אחת כל שלושה שבועות, לסך כולל של שמונה אינפוזיות.
המינון מותאם למשקל הגוף בפועל – המנה הראשונה ניתנת במינון של 10 מ”ג/ק”ג, ולאחר מכן ניתנות שבע מנות נוספות של 20 מ”ג/ק”ג.
לצד היעילות המרשימה, דווחו תופעות לוואי, שמקורן בפעולת התרופה על קולטני IGF-1.
תופעה שכיחה יחסית היא היפרגליקמיה, בעיקר בקרב מטופלים עם סכרת קיימת או טרום-סוכרת.
החמרה נצפתה ב-10% מהמטופלים ונבעה ככל הנראה מירידה בפעילות הקולטנים לאינסולין ו IGF-1, עם השפעה על איזון גלוקוז ורגישות לאינסולין. 14
בסדרה שכללה 42 מטופלים, מחציתם סוכרתיים או פרה-סוכרתיים, דווח כי 52% מהם חוו החמרה גליקמית ממושכת – נתון שממחיש את חשיבות המעקב המטבולי במהלך הטיפול. 15
בנוסף, תוארו הפרעות שמיעה, כולל טנטון, ירידה בתדרים גבוהים, תחושת אטימות באוזניים ואוטופוניה.
לפי דיווחים, 15.2% חוו פגיעה שמיעתית, עם שיפור חלקי ב 8.4% והתמשכות התסמינים ב 6.8%. 16
דיווחים אחרים הראו שיעור חזרה של התסמינים לאחר הפסקת הטיפול בשיעור של 11% ומעלה.
תופעות נוספות שתועדו כוללות שלשולים, עייפות, כיווצי שרירים, נשירת שיער, שינויים במחזור החודשי, תגובות אינפוזיה והחמרה של IBD. 17 מקרים נדירים מאד על אנצפלופתיה תוארו, לרוב לאחר מנות מוקדמות, עם תגובה טובה לפלזמהפרזיס. 18,19 דווחו גם מקרים של שבריריות ציפורניים ודיסטרופיה של מיטת הציפורן,20 וכן שינויים בפיגמנטציה של העור, כולל החמרת ויטיליגו. 21
הניסיון הישראלי
במחקר רטרוספקטיבי רב מרכזי ראשון מסוגו בישראל, שכלל חמישה בתי חולים בישראל (המרכז הרפואי שיבא - תל השומר, מרכז רפואי צפון ע״ש פדה – פורייה, בית חולים בילינסון, בית חולים הדסה ומרכז רפואי סורוקה), נבדקו 32 מטופלים עם TED פעילה בדרגות חומרה שונות, שקיבלו טפרוטומומאב בין השנים 2021 ל – 2024.[ המאמר “Time to Improvement Following Teprotumumab Treatment of Thyroid Eye Disease: Real World Experience” הוגש לפרסום ב-Graefe’s Archive for Clinical and Experimental Ophthalmology. ] כלל המטופלים נכשלו קודם לכן בטיפול בסטרואידים תוך ורידיים לפי פרוטוקול EUGOGO, ובחלק מהמקרים גם בטיפולים ביולוגיים נוספים, לרבות anti-IL-6, MMF, וMTX.
הממצאים מצביעים על יעילות קלינית מובהקת ומשמעותית של טפרוטומומאב. נרשמה ירידה בפרופטוזיס של 2.4 מ״מ בעין ימין, ו 2.0 מ״מ בשמאל (P<0.001 ו P=0.002 בהתאמה). בקרב 24 מטופלים עם כפל ראייה לפני הטיפול נרשמה ירידה משמעותית במבט ראשי (P=0.015, מבחן חי בריבוע). נתון מפתיע הוא שב – 40.6% מהמטופלים חלה משמעותית כבר לאחר שלוש אינפוזיות או פחות, ממצא המשתלב היטב עם תוצאות מחקרי שלב II ו-III ונתונים מהשטח. 5,12,22 ארבעה מטופלים חוו חזרה של דלקת בארובה תוך 8–12 חודשים לאחר סיום הטיפול (12.5%), ואחד מהם הגיב היטב למחזור שני. לא נצפתה שונות בתגובה לפי מין או עישון, ורמות TSI ירדו אך לא באופן מובהק סטטיסטית.
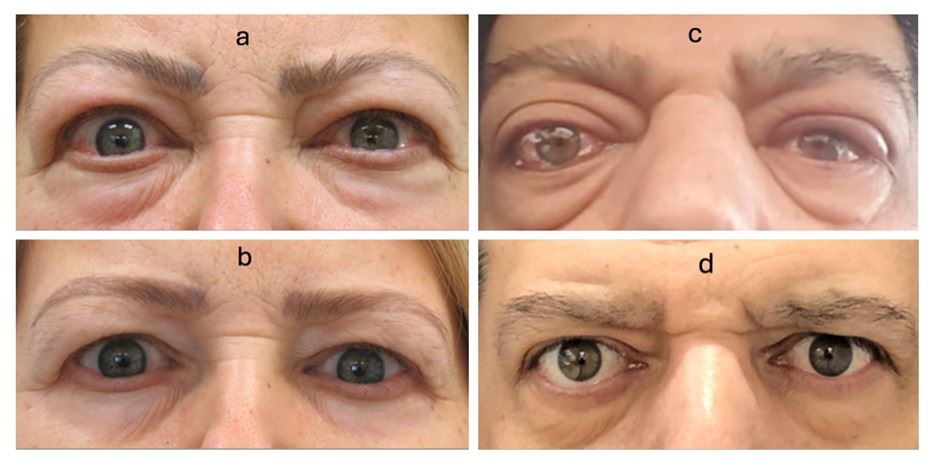
איור 1: מטופלים במהלך טיפול בטפרוטומומאב – לפני ואחרי.
(a) לפני הטיפול: אישה בת 58 עם מחלת עיניים תירואידית פעילה (TED), מציגה פרופטוזיס בעין ימין, רטרקצית עפעפיים וכימוזיס. הגדלה של שרירי העין החיצוניים גרמה להגבלה בתנועתיות העין ולכפל ראייה.
(b) לאחר השלמת סדרת טיפול בת 8 מנות טפרוטומומאב: ירידה ניכרת בפרופטוזיס, ברטרקצית העפעף ובבצקת הלחמית, וכן חל שיפור בכפל הראייה. נותרה חשיפה קלה ומגבלה מסוימת בתנועתיות.
(c) לפני הטיפול: גבר בן 50 עם TED פעילה, סובל מפרופטוזיס, הגבלה במבט כלפי מעלה, ירידה ברגישות לניגודיות וכאבים בתנועות עיניים.
(d) לאחר טיפול בודד של טפרוטומומאב: ירידה ניכרת בפרופטוזיס ושיפור בכימוזיס, שיפור בכאב הלחץ ובתחושת הגודש.
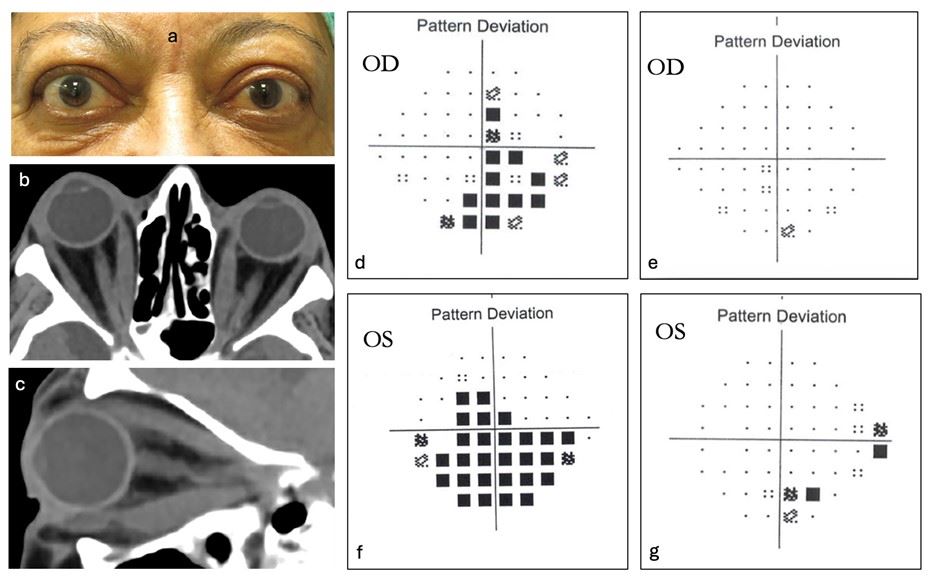
איור 2: מטופלת בת 73 נוירופתיה אופטית דיסתירואידית דו-צדדית, שנגרמה בעיקר עקב משיכה של עצב הראייה (b-c).
שלב המחלה הפעילה נמשך כ-6 חודשים, עם חדות ראייה של 6/18 בעין ימין ו-6/20 בעין שמאל, ירידה בראיית צבעים ופרופטוזיס ניכר (a).
המטופלת עברה ניתוח דה-קומפרסיה ללא שיפור משמעותי, אך הפגינה תגובה דרמטית לאחר שתי אינפוזיות בלבד של טפרוטומומאב.
ניתן להתרשם משיפור ניכר בשדה הראיה (d-g) מימין ומשמאל, וזאת למרות היעדר סימנים ברורים לדלקת אקטיבית בארובה.
הפרופיל הבטיחותי שתועד במחקר הישראלי, היה דומה לזה שתואר בספרות הבינלאומית, עם תופעות לוואי נסבלות ברובן.
ארבעה מטופלים (12.5%) דיווחו על כאבי שרירים, שלושה (9.3%) על היפרגליקמיה, ושלושה נוספים על שלשולים. ארבעה מטופלים (12.5%) חוו הפרעות שמיעה או טנטון – שיעור דומה לדיווחים בספרות המקצועית. 16 מטופל אחד פיתח אנצפלופתיה עם ירידה בתפקוד הקוגניטיבי לאחר המנה השנייה, והשתפר לאחר פלזמהפרזיס 18,19.
תופעות בודדות נוספות כללו חניכיים נסוגים, ירידה במשקל, שיעול, אפטות בפה, הפסקת מחזור זמנית, החמרת ויטיליגו ושבריריות ציפורניים (כולל דיסטרופיה).
למרות מגוון התסמינים, מרבית המטופלים (29/32) השלימו את כל מהלך הטיפול ללא צורך בהפסקתו, והטיפול הוגדר על ידם כנסבל היטב.
אישור על ידי סל הבריאות
בשנת 2025, בעקבות פעילות של האיגוד לרפואת עיניים בהובלת יו"ר החוג הישראלי לאוקולופלסטיקה, איגוד רופאי העיניים בישראל וועדת הסל נכנסה טפזה לסל התרופות בישראל, ואושרה לשימוש במקרים של TED פעילה בדרגת חומרה בינונית-חמורה (CAS>=3) עם בלט עין ניכר ו/או הגבלה בתנועת עין אחת לפחות.
מדובר בציון דרך משמעותי עבור מטופלים רבים, אשר נמנעו בעבר מטיפול עקב עלותו הגבוהה.
הכללת התרופה בסל מאפשרת כעת למטופלים הזקוקים לה ביותר לקבל טיפול מתקדם, יעיל ומבוסס ראיות, אשר עשוי לשפר באופן ניכר את איכות החיים והתפקוד היום יומי של המטופלים.
סיכום
טפרוטומומאב מהווה פריצת דרך טיפולית במחלת TED, עם יעילות מוכחת הן במחקרים קליניים מבוקרים והן בנתוני עולם אמיתי.
מחקרים הדגימו שיפור בפרופטוזיס וכפל ראייה גם באוכלוסייה מגוונת, כולל מטופלים כרוניים וכאלה שלא הגיבו לטיפולים קודמים.
תגובה מוקדמת נצפתה בקרב רבים וחלקם השיגו שיפור כבר לאחר שלוש אינפוזיות בלבד.
ישנה חשיבות למעקב צמוד לאבחנה מוקדמת של תופעות הלוואי וניהול מתאים.
ממצאים אלו תומכים בשימוש מושכל בטפזה בניהול מחלת TED לאחר בדיקה והערכה מלאה של רופא עיניים בתחום הפלסטיקה ובשילוב אנדוקרינולוגים ואימונולוגים.
References
-
Bartalena, L. et al. The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. Eur. J. Endocrinol. 185, G43–G67 (2021).
-
Hoang, T. D., Stocker, D. J., Chou, E. L. & Burch, H. B. 2022 Update on Clinical Management of Graves Disease and Thyroid Eye Disease. Endocrinol. Metab. Clin. North Am. 51, 287–304 (2022).
-
Kahaly, G. J. Immunotherapies for thyroid eye disease. Curr. Opin. Endocrinol. Diabetes Obes. 26, 250 (2019).
-
Salvi, M., Vannucchi, G. & Beck-Peccoz, P. Potential utility of rituximab for Graves’ orbitopathy. J. Clin. Endocrinol. Metab. 98, 4291–4299 (2013).
-
Teprotumumab for the Treatment of Active Thyroid Eye Disease | New England Journal of Medicine. https://www.nejm.org/doi/full/10.1056/NEJMoa1910434.
-
Kahaly, G. J., Douglas, R. S., Holt, R. J., Sile, S. & Smith, T. J. Teprotumumab for patients with active thyroid eye disease: a pooled data analysis, subgroup analyses, and off-treatment follow-up results from two randomised, double-masked, placebo-controlled, multicentre trials. Lancet Diabetes Endocrinol. 9, 360–372 (2021).
-
Douglas, R. S. et al. Teprotumumab for the Treatment of Active Thyroid Eye Disease. N. Engl. J. Med. 382, 341–352 (2020).
-
Smith, T. J. et al. Teprotumumab for Thyroid-Associated Ophthalmopathy. N. Engl. J. Med. 376, 1748–1761 (2017).
-
Ugradar, S. et al. Teprotumumab for the treatment of chronic thyroid eye disease. Eye Lond. Engl. 36, 1553–1559 (2022).
-
Ozzello, D. J., Kikkawa, D. O. & Korn, B. S. Early experience with teprotumumab for chronic thyroid eye disease. Am. J. Ophthalmol. Case Rep. 19, 100744 (2020).
-
Douglas, R. S. et al. Efficacy and Safety of Teprotumumab in Patients With Thyroid Eye Disease of Long Duration and Low Disease Activity. J. Clin. Endocrinol. Metab. 109, 25–35 (2023).
-
Diniz, S. B., Cohen, L. M., Roelofs, K. A. & Rootman, D. B. Early Experience With the Clinical Use of Teprotumumab in a Heterogenous Thyroid Eye Disease Population. Ophthal. Plast. Reconstr. Surg. 37, 583 (2021).
-
vasundhara. US FDA approves label update for Horizon’s Tepezza TED drug. Pharmaceutical Technology https://www.pharmaceutical-technology.com/news/fda-horizon-tepezza-ted-drug/ (2023).
-
Adverse Effects Profile of Teprotumumab | The Journal of Clinical Endocrinology & Metabolism | Oxford Academic. https://academic.oup.com/jcem/article/108/9/e654/7127890?login=false.
-
Amarikwa, L., Mohamed, A., Kim, S. H., Kossler, A. L. & Dosiou, C. Teprotumumab-Related Hyperglycemia. J. Clin. Endocrinol. Metab. 108, 858–864 (2023).
-
Bartalena, L., Marinò, M., Marcocci, C. & Tanda, M. L. Teprotumumab for Graves’ orbitopathy and ototoxicity: moving problems from eyes to ears? J. Endocrinol. Invest. 45, 1455–1457 (2022).
-
Safo, M. B. & Silkiss, R. Z. A case of ulcerative colitis associated with teprotumumab treatment for thyroid eye disease. Am. J. Ophthalmol. Case Rep. 22, 101069 (2021).
-
Rapidly progressive cognitive decline associated with teprotumumab in thyroid eye disease | BMJ Case Reports. https://casereports.bmj.com/content/14/5/e242153.abstract.
-
Yee, M. D., McCarthy, J., Quinn, B. & Surani, A. Teprotumumab-Induced Encephalopathy: A Rare Side Effect of a Novel Therapeutic. WMJ 122, 134–137 (2023).
-
Wang, X.-L., Xu, S.-S., Zhou, J.-B. & Song, Z.-H. An observational study on the safety of teprotumumab based on FAERS database. Endocrine 85, 313–320 (2024).
-
Shah, S. A. et al. Teprotumumab-Related Adverse Events in Thyroid Eye Disease: A Multicenter Study. Ophthalmology 131, 458–467 (2024).
-
Teprotumumab for Thyroid-Associated Ophthalmopathy | New England Journal of Medicine. https://www.nejm.org/doi/full/10.1056/NEJMoa1614949.